Divulgación
Onicomicosis – Diagnóstico y tratamiento
Publicado
hace 4 añosel

Índice
Introducción Onicomicosis
Las onicomicosis deben diagnosticarse correctamente debido a que los tratamientos son largos, costosos y no están libres de riesgos. Es necesario establecer el diagnóstico diferencial con otro tipo de procesos causantes de distrofia ungueal como psoriasis, traumatismos, liquen plano, onicocriptosis y/o atrofia ungueal.
Se debe realizar una adecuada anamnesis, interrogando sobre la existencia de enfermedades de base como la diabetes y otras causas de inmunosupresión, hábitos del paciente (contacto con agua, asistencia a lugares donde se anda descalzo y en ambiente húmedo como piscinas, vestuarios, duchas compartidas, etc.) y profesión, por la exposición a traumatismos o a productos irritantes (deportista, albañil, pintor…).
La historia y exploración del paciente debe incluir, además de la lesión motivo de la consulta, el resto de la superficie corporal, buscando lesiones satélites a distancia. En pacientes con lesiones cutáneas crónicas o recurrentes sugerentes de dermatofitosis se deben explorar siempre los pies buscando signos de micosis.
Aunque las manifestaciones clínicas y el aspecto de la uña es lo que mejor nos orienta hacia un diagnóstico definitivo, a veces, las lesiones no son lo suficientemente claras, y por ello debemos recurrir a la confirmación de laboratorio mediante un examen micológico. Actualmente se dispone de cuatro tipos de examen micológico: visualización directa, cultivo, histopatología y reacción en cadena de la polimerasa (PCR). La visualización directa consiste en la observación de las muestras ungueales en microscopio y el reconocimiento de los elementos fúngicos.
Se incuban las muestras obtenidas con hidróxido de potasio entre el 10-20% , el cual disuelve la queratina que se ablanda y aclara parcialmente para facilitar la visualización de elementos fúngicos y su posterior visualización en el microscopio a 400 aumentos. El hidróxido de potasio deja intacta la célula fúngica.
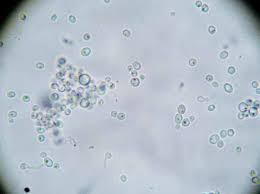
Este método permitirá visualizar elementos fúngicos que confirmen la infección, pero no identificará el organismo que lo causa.
Podría ser suficiente para confirmar el diagnóstico permitiendo iniciar un tratamiento fúngico inmediatamente, pero la identificación final del hongo que causa la onicomicosis solo puede realizarse mediante cultivo. El cultivo es fundamental para identificar el agente etiológico pudiendo establecer o modificar el tratamiento.
Es una prueba complementaria que se realizará tomando muestras de la lámina ungueal, detritus subungueal o polvo ungueal por raspado o fresado colocándolo en una Placa de Petri con el fin de provocar el crecimiento fúngico e identificar el agente causal.

La recogida de la muestra debe realizarse antes de comenzar el tratamiento antifúngico.
Si el paciente ha recibido un tratamiento previo se debe esperar un tiempo después de la suspensión del mismo antes de la toma de muestras: 15 días si se han utilizado cremas antifúngicas, 1 mes para las lacas y de 1-3 meses para los antifúngicos sistémicos (1 mes para la griseofulvina y 3 para la terbinafina)
El diagnóstico microbiológico consiste en la visualización del hongo en la muestra y el cultivo de la misma para identificar el género y especie de hongo causal.
El éxito del diagnóstico depende mucho de la calidad de la muestra recogida, de la experiencia del microbiólogo en la visualización microscópica y la discriminación entre hongos que están ejerciendo una acción patógena, hongos saprofitos de la uña y hongos contaminantes de los medios de cultivo.
En ocasiones hay discordancias, con resultados positivos en la visualización directa de la muestra y cultivos negativos, debido generalmente a tratamientos antifúngicos recientes o a los problemas de viabilidad de las hifas que invaden la lámina ungueal.
La siembra de las muestras de la lámina ungueal en medio de Sabouraud (agar glucosado a PH 5,6) a 37º permite el crecimiento de los hongos con características morfológicas propias facilitando así su identificación.
A este medio se le suele añadir cloranfenicol o gentamicina con la finalidad de impedir el crecimiento bacteriano y ciclohexamida para inhibir el crecimiento de los hongos saprofitos.
Las diferentes especies de hongos adquieren características diferentes en los medios de cultivo, permitiendo obtener datos para hacer un diagnóstico etiológico.
Los cultivos se incuban durante un mes a 25-30ºC en el caso de dermatofitos y mohos no dermatofitos y entre 25ºC y 37ºC las levaduras.
Los mohos no dermatofitos crecen más rápido que los dermatofitos y producen colonias bien formadas en una semana. Los dermatofitos crecen en 2 a 4 semanas.
Las especies Candida aparecen a las 24-36 horas después y medirán de 1,5 a 2mm de diámetro de 5 a 7 días después. Crecen en una semana.
El estudio histopatológico se lleva a cabo en laboratorios especializados a partir de biopsias (por bisturí o punch) de tejido ungueal.
Consiste en el estudio de cortes histológicos de tejido infectado por hongos. La tinción de ácido peryódico de Schiff (PAS) evidencia algunos polisacáridos y permite visualizar elementos infecciosos como los hongos, ya que sus paredes de celulosa y quitina contienen polisacáridos. Da lugar a una coloración rojopúrpura característica. Este método no permite identificar la especie ni el género del agente causal. Proporciona la misma información que el examen directo.

La PCR es una técnica cuyo objetivo es obtener un gran número de copias de un fragmento de ADN del hongo a partir de su amplificación. Es válida solo para la detección de hongos dermatofitos. No determina la especie.
Tratamiento de la Onicomicosis
La onicomicosis es una de las micosis superficiales con mayor dificultad en el tratamiento. Sobre ésta recae una elevada tasa de fracaso terapéutico, entre 20-50%. Actualmente las opciones terapéuticas para tratar esta patología son las siguientes:
Antifúngicos tópicos
El tratamiento tópico está indicado en onicomicosis superficiales con afectación inferior al 50% de la lámina ungueal.
En la actualidad disponemos de antifúngicos formulados en bases de lacas, consiguiendo que el principio activo contacte con la uña un período más largo de tiempo y a una concentración eficaz.
Este tipo de tratamiento no tiene efectos secundarios graves, pero proporcionan una eficacia limitada.
En caso de no apreciarse respuesta tras 6 meses se debe valorar cambiar de tratamiento.
Los fármacos más empleados son:
- Amorolfina. Es un fungicida de amplio espectro. Actúa inhibiendo la síntesis de ergosterol en la membrana celular del hongo. Penetra a través de las distintas capas de la uña y su absorción a nivel plasmático es indetectable. Se aplica una o dos veces por semana, durante 6 meses para las uñas de las manos y 9-12 meses en las de los pies. El prurito y la dermatitis de contacto son sus principales efectos secundarios.
- Ciclopirox olamina. Es un fungicida de amplio espectro. Inhibe la absorción de potasio, fosfato y aminoácidos ocasionando la muerte celular. Durante el primer mes se aplica cada 48 horas, el segundo mes dos veces por semana y a partir de tercer mes una aplicación semanal, no superando los seis meses de tratamiento.
- Tioconazol. Es fungistático y de amplio espectro. Pertenece a la familia de los azoles y actúa inhibiendo la síntesis de ergosterol. Se aplica dos veces al día, durante un periodo variable dependiendo del tipo de hongo y de la lesión.
No hay estudios comparativos adecuados entre dos tratamientos tópicos, aunque la amorolfina parece el tratamiento tópico más efectivo hasta el momento.
Antifúngicos sistémicos
El tratamiento oral está recomendado en aquellos tipos de onicomicosis que presenten una afectación superior al 50% de la lámina ungueal, afectación de varias uñas y falta de respuesta tras 6 meses de tratamiento tópico.
Un gran inconveniente de esta opción terapéutica es la eliminación por vía hepática y renal de los fármacos y sus posibles efectos adversos.
Los antifúngicos orales más comunes son:
- Terbinafina. Pertenece al grupo de las alilaminas, que interfieren la síntesis del ergosterol. Su acción es la suma del efecto fungistático y fungicida. Se utilizan 250 mg/día (un mínimo 12 semanas en los pies y 6 semanas en las manos). El tratamiento antifúngico y la limpieza mecánica debe continuarse el tiempo que sea necesario hasta la curación, siempre que el paciente tolere el tratamiento (se deben realizar controles periódicos de transaminasas).
- Itraconazol. Es un antifúngico triazólico sintético que actúa inhibiendo la síntesis del ergosterol. El tratamiento se hace habitualmente de forma continua durante un mínimo de 12 semanas para las uñas de los pies y 6 semanas para las de las manos, administrando 200 mg/día. Se metaboliza por vía hepática excretándose un gran número de metabolitos a través de las heces y la orina.
- Griseofulvina. Es un antimicótico fungistático solo útil para dermatofitos. Bloquea la reproducción del hongo inhibiendo el proceso de mitosis. En adultos la dosis recomendada es de 500-1000 mg/día durante 6-9 meses para las uñas de las manos y 12-18 meses para las de los pies. Su uso está contraindicado en enfermedades hepáticas graves, lupus eritematoso sistémico y porfiria.
- Fluconazol. Es un antimicótico fungicida del que se administran 150 mg una vez a la semana hasta el crecimiento completo de la uña.
Tratamiento con láser
La alta toxicidad de los antifúngicos y la interacción de los azoles con otros medicamentos hacen que su uso esté limitado y no se recomiende en pacientes polimedicados, inmunocomprometidos, cardiópatas y/o con afectación hepática.
Debido a los diferentes inconvenientes que presentan el uso de los antifúngicos: larga duración del tratamiento, el mal cumplimiento por parte del paciente, la severidad de los efectos secundarios, el rechazo del paciente a una terapia sistémica, así como la baja respuesta de los pacientes al tratamiento, nacen nuevas terapias para combatir esta afectación.
El empleo de láser en esta patología forma parte de la búsqueda de soluciones eficaces no invasivas y de fácil aplicación.
Láser son las siglas de amplificación de luz por emisión estimulada de radiación.
Aunque no está bien definido el método de acción de los láseres lumínicos para el tratamiento de la onicomicosis, todo indica que lo consigue mediante la fototermólisis selectiva que consiste en la aplicación de luz en los pigmentos de los hongos con una generación consecutiva de temperaturas superiores a 50ºC.
Este calentamiento del tejido provoca la destrucción de las estructuras fúngicas y por lo tanto la erradicación de la infección en la uña.
Diversos estudios informan que la aplicación de los láseres para el tratamiento de la onicomicosis es efectiva y no provoca efectos adversos significativos, excepto dolor y calor tolerables.
El aparato se compone de 3 partes:
- Fuente de láser: donde se genera la radiación y que incluye un sistema para su calibración.
- Sistema de transmisión: habitualmente de fibra óptica.
- Aplicador: diversas piezas de manos de diferentes diámetro o con accesorios opcionales para el barrido.
El número de sesiones de tratamiento suele ser en torno a 8 sesiones hasta conseguir la curación completa, realizando una consulta de seguimiento entre 3-6 meses tras el fin del tratamiento.
Bibliografía
- Alfaro D., González C. Onicomicosis en pediatría: actualización y tratamiento. Rev Chil Pediatr 2020;91(1):20-30.
- Ramírez L., Gómez A., Sánchez D., Arenas R. Onicomicosis por mohos no dermatofitos. Dermatol CMQ 2017; 15(3):184-194.
- Pupiales J., López S., Guerrero M., Guamán C. Onicomicosis por Tricophyton rubrum. Recimundo 2020;4(2):127-133.
- Altamirano K., Acurio T., Altamirano J. Onicomicosis: diagnóstico y tratamiento. Reciamuc 2020;4(4):24-31.
- Pérez J., Casado I., Santiago F. Técnica de examen directo de la onicomicosis mediante miscroscopía con hidróxido de potasio. Rev Esp Podol 2017;28(1):46-52

Caso Clínico
Microinjertos Cutáneos – Casos Clínicos
Publicado
hace 1 semanael
18 de noviembre de 2025Por
CMUC Admin
En el primer blog de esta serie de blogs sobre los microinjertos cutáneos, os explicamos los fundamentos de la técnica Hy-Tissue Micrograft (HT-MG): un procedimiento mínimamente invasivo que utiliza microfragmentos de piel autóloga para estimular la cicatrización en heridas crónicas cuando los tratamientos convencionales no han sido eficaces.
En este segundo artículo, nos centramos en la experiencia clínica recogida en el estudio: cinco pacientes con heridas de etiologías diversas tratados mediante HT-MG.
Se trata de un estudio analítico, observacional, transversal y prospectivo, para evaluar la eficacia clínica de esta técnica en términos de cierre de la herida, disminución del dolor y seguridad del procedimiento, manteniendo un enfoque práctico y reproducible en el entorno asistencial.
Índice
Perfil de los pacientes y características de las heridas
El estudio incluyó un total de cinco pacientes, seleccionados tras valorar que sus heridas no respondían de forma adecuada al tratamiento convencional con cura en ambiente húmedo (CAH).
La edad media fue de 63,8 años, con cuatro mujeres y un hombre, y una evolución media de las lesiones de dos años, lo que refleja la cronicidad de los casos. El tamaño medio de las heridas fue de 45,8 cm², con variaciones según la localización y etiología.
Las causas de las lesiones fueron variadas, lo que permitió observar la aplicación de la técnica en distintos contextos clínicos:
-
Enfermedad de Hansen
-
Dos úlceras venosas
-
Una lesión por dermatoporosis grado IV
-
Una úlcera neuropática plantar
Todas las heridas se encontraban limpias, sin signos de infección activa y con un lecho apto para la técnica HT-MG, cumpliendo los criterios establecidos para garantizar la viabilidad del injerto.
Los cinco casos incluidos en el estudio muestran la aplicación práctica de la técnica HT-MG en heridas de distinta etiología, con resultados globalmente positivos.
Caso 1 – Lesión por enfermedad de Hansen
Paciente diagnosticado de enfermedad de Hansen con una lesión cutánea crónica que no respondía al tratamiento convencional.
Tras aplicar el microinjerto autólogo mediante HT-MG, se observó una evolución progresiva hacia la cicatrización, con una reducción del tamaño de la herida hasta un residuo final de 2 × 2 cm al cierre del seguimiento.
Caso 2 – Úlcera venosa crónica
Paciente con úlcera venosa de larga evolución.
Tras la aplicación de HT-MG, se evidenció una mejoría rápida en el aspecto del lecho y una epitelización progresiva, alcanzando la cicatrización completa durante el periodo de seguimiento.
Caso 3 – Úlcera venosa crónica
Segundo caso de etiología venosa, con características clínicas similares al anterior.
El tratamiento con HT-MG permitió una evolución favorable, con formación de nuevo tejido epitelial y cierre completo de la lesión sin complicaciones.
Caso 4 – Dermatoporosis grado IV
Paciente con dermatoporosis avanzada (grado IV), que presentaba una lesión atrófica persistente.
La aplicación de microinjertos cutáneos favoreció una respuesta cicatricial notable, con cierre completo de la herida en las semanas posteriores y mejora del tejido circundante.
Caso 5 – Úlcera neuropática plantar
Caso de úlcera neuropática en la planta del pie, con evolución tórpida pese al manejo convencional.
El procedimiento HT-MG consiguió una epitelización completa sin signos de infección ni recidiva, lo que confirma su utilidad en este tipo de lesiones complejas.
Resultados generales y observaciones clínicas
Los resultados globales del estudio muestran una respuesta positiva en todos los casos tratados con microinjertos cutáneos HT-MG. La técnica permitió reducir los tiempos de cicatrización, disminuir el dolor y mejorar la calidad del tejido epitelial obtenido tras el cierre de las heridas.
El tiempo medio de cicatrización fue de aproximadamente 2,5 meses, con una evolución satisfactoria y sin necesidad de hospitalización. Ninguno de los pacientes presentó signos de colonización bacteriana ni infección local tras la aplicación.
El sitio donante (de donde se obtuvieron las biopsias de piel) mostró una recuperación completa entre los 7 y 15 días, sin complicaciones relevantes.
Además, se destacó la facilidad de aplicación del procedimiento, lo que sugiere que puede integrarse en el ámbito ambulatorio o en atención primaria, siempre que se cumplan los requisitos de asepsia, limpieza del lecho y estado general adecuado del paciente.
Consideraciones técnicas y biológicas
El éxito de la técnica se apoya en su base biológica: los microfragmentos obtenidos conservan la matriz extracelular (MEC), que actúa como soporte estructural y favorece la regeneración tisular al mantener nichos celulares activos y factores de crecimiento.
Desde el punto de vista mecánico, se hace referencia al principio de tensegridad, según el cual la estructura de la MEC mantiene la conexión entre las células y el entorno, facilitando su supervivencia e integración en el tejido receptor.
Conclusiones del estudio
El uso de microinjertos cutáneos autólogos (HT-MG) se presenta como una alternativa eficaz y mínimamente invasiva en el tratamiento de heridas crónicas que no responden a los métodos convencionales.
La técnica permite acortar los tiempos de cicatrización, reducir el dolor y obtener una cicatriz funcional y estéticamente aceptable, sin complicaciones infecciosas ni efectos secundarios relevantes.
Entre sus ventajas se encuentran:
-
Procedimiento ambulatorio, sin necesidad de hospitalización.
-
Recuperación rápida del sitio donante.
-
Aplicación sencilla y reproducible, adaptable al entorno de atención primaria o unidades de heridas.
No obstante, el éxito del tratamiento depende de una correcta selección del lecho, que debe estar bien irrigado y libre de tejido necrótico, fibrinoso o infectado.
La técnica no debe aplicarse directamente sobre hueso o tendón expuesto, ya que comprometería la viabilidad del injerto.
El trabajo demuestra que los microinjertos cutáneos HT-MG pueden ser una herramienta útil dentro del abordaje integral de las heridas complejas, especialmente cuando otras terapias no han logrado resultados satisfactorios.
En CMUC, apostamos por la incorporación de técnicas basadas en evidencia, seguras y adaptadas al paciente, que permitan avanzar hacia una cicatrización más rápida y eficaz.
👉 Si te perdiste la primera parte de esta serie, puedes leerla aquí para conocer cómo funciona la técnica HT-MG paso a paso.
Y no olvides seguirnos para descubrir más sobre las nuevas terapias avanzadas en el tratamiento de heridas crónicas.
Divulgación
Microinjertos Cutáneos
Publicado
hace 3 semanasel
4 de noviembre de 2025Por
CMUC Admin
El objetivo de esta serie de dos blogs es explicar, de forma clara, una técnica para tratar heridas de difícil cicatrización mediante microinjertos cutáneos autólogos.
En este primer blog resumimos qué es la técnica, cómo se realiza, qué materiales requiere, cuándo no debe aplicarse y qué resultados globales se observaron.
En el segundo blog presentaremos los casos clínicos incluidos en el estudio (enfermedad de Hansen, úlceras venosas, dermatoporosis grado IV y úlcera neuropática plantar), con su evolución y hallazgos principales.
¿Por qué hablar de esto? Porque las heridas crónicas consumen muchos recursos, elevan los costes y empeoran la calidad de vida. Suelen mantenerse en inflamación persistente, con proteasas elevadas que dificultan la regeneración, alteran la matriz extracelular (MEC) y la angiogénesis, favoreciendo una cicatrización deficiente. La microfragmentación tisular se propone como alternativa mínimamente invasiva, capaz de estimular la cicatrización en casos donde el tratamiento convencional no ha sido suficiente.
Este trabajo evalúa la técnica HT-MG en un entorno especializado y describe su aplicación práctica y resultados.
Índice
Qué son los microinjertos cutáneos (HT-MG)
Los microinjertos cutáneos autólogos son pequeños microfragmentos de piel obtenidos del propio paciente a partir de biopsias. Mediante un dispositivo estéril de un solo uso (Hy-tissue Micrograft, HT-MG), esas biopsias se fragmentan mecánicamente para generar una suspensión de microinjertos que se aplica en el lecho de la herida y se infiltra en los bordes con el objetivo de estimular la cicatrización cuando los tratamientos convencionales no han sido suficientes.
Materiales y dispositivo necesarios
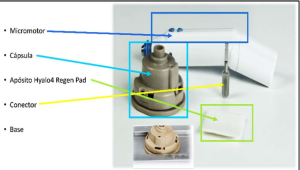
Para realizar la técnica se emplea el dispositivo Hy-tissue Micrograft (HT-MG), formado por:
-
Micromotor
-
Cápsula de microfragmentación con su conector
-
Base metálica para la fragmentación
Además, se utiliza instrumental de cirugía menor para la obtención y manejo de las biopsias cutáneas.
Procedimiento clínico (paso a paso)
1) Preparación del área
-
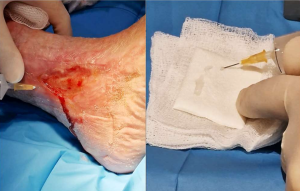
Desinfectar el sitio donante y limpiar la herida.
2) Obtención de biopsias
-
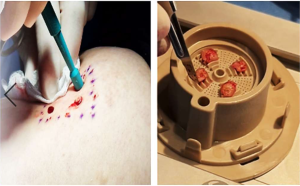
Tomar cuatro biopsias de piel del sitio donante.
-
Colocarlas en la rejilla de la cápsula de fragmentación.
3) Preparación de la cápsula
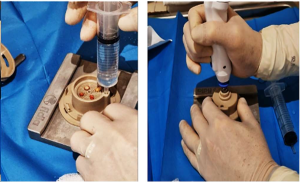
-
Cargar la cápsula con 15 ml de suero fisiológico estéril, sellarla y conectarla al micromotor.
4) Microfragmentación
-
Fragmentación mecánica durante 1 minuto hasta obtener una suspensión turbia de microinjertos.
-
Mantener la herida húmeda con PHMB durante el proceso.
-
Analgesia en bordes según sensibilidad: crema de lidocaína o vaporización de nitrógeno líquido.
-
Infiltrar microfragmentos en la periferia (~0,5 mm hacia la herida) y aplicar en el lecho.
5) Aplicación y cobertura
-
Aplicar la suspensión de microfragmentos sobre el lecho de la herida.
-
Depositar el sobrante sobre un apósito bioactivo de colágeno y ácido hialurónico (Hyalo4 Regen®) y colocarlo sobre la herida.
-
Cubrir con espuma siliconada o apósito con PHMB y asegurar con vendaje (compresivo o de sujeción según etiología).
-
En el sitio donante, colocar fragmentos de 5 mm del apósito Hyalo4 Regen® saturados con el sobrante en los huecos de las biopsias.
Contraindicaciones
La técnica no debe aplicarse cuando el injerto tenga pocas probabilidades de prender por falta de irrigación o por un lecho inadecuado. En concreto, se evita en presencia de:
-
Necrosis en placa
-
Tejido esfacelar
-
Tejido fibrinoso
-
Exposición de tendones o de hueso
En estas situaciones, primero hay que optimizar el lecho (desbridar, controlar la infección, mejorar perfusión, etc.) y solo después valorar el microinjerto.
Para realizar el procedimiento con garantías, se requieren dos condiciones básicas:
-
-
Paciente en buen estado general.
-
Lecho de la herida limpio y sin signos de infección.
-
Por qué funciona esta técnica
La microfragmentación cutánea (HT-MG) conserva la matriz extracelular (MEC) como andamiaje natural, lo que favorece la organización del tejido y mantiene nichos celulares útiles para la reparación. En la suspensión resultante hay células viables (como fibroblastos y queratinocitos), además de citocinas y factores de crecimiento implicados en la cicatrización. También se han observado queratina acelular, epitelio, fibrina y linfocitos, elementos que acompañan al proceso de regeneración.
Desde el punto de vista mecano-biológico, el artículo menciona el principio de tensegridad: la MEC contribuye a mantener la conexión célula–MEC y la estabilidad por tensión, lo que favorece la integración de los microinjertos en el lecho receptor.
Resultados observables
-
Tiempo medio de cicatrización aproximado: 2,5 meses.
-
Disminución del dolor durante la evolución.
-
Sin complicaciones por colonización o infección reportadas.
-
Sitio donante con recuperación rápida (7–15 días).
-
Procedimiento sencillo y realizable sin hospitalización, con potencial de implantación en atención primaria.
La microfragmentación de piel con HT-MG es una opción mínimamente invasiva que aprovecha tejido autólogo para estimular la cicatrización en heridas complejas, siempre que el lecho esté limpio y bien irrigado y se eviten las contraindicaciones descritas.
En el próximo blog presentaremos los casos clínicos incluidos en el trabajo (enfermedad de Hansen, úlceras venosas, dermatoporosis grado IV y úlcera neuropática plantar), con su evolución y resultados.
Divulgación
Cura húmeda y cura seca: diferencias
Publicado
hace 2 mesesel
7 de octubre de 2025Por
CMUC Admin
En este artículo explicamos las diferencias más importantes entre la cura húmeda y la cura seca en el tratamiento de heridas.
Las heridas crónicas suelen tener una duración prolongada y una alta tasa de complicaciones. Entre los principales factores que retrasan su cicatrización se encuentran:
-
Un estado inflamatorio crónico o mantenido.
-
El desequilibrio entre proteasas e inhibidores de proteasas en el lecho de la herida.
-
La colonización bacteriana y la presencia de biofilm.
-
La acumulación de especies reactivas de oxígeno (ROS).
Índice
Curas húmedas
La cura en ambiente húmedo (CAH) en heridas crónicas ha demostrado grandes beneficios:
-
Acelera la cicatrización, gracias al mantenimiento de un nivel de humedad óptimo.
-
Proporciona mayor protección frente a la colonización bacteriana.
-
Es una técnica más versátil que la gasa tradicional, ya que existen numerosos apósitos adaptados a cada necesidad (absorción, impermeabilidad, acción antibacteriana…).
-
Es un procedimiento menos doloroso y menos traumático, porque los apósitos no se adhieren ni a la piel ni al lecho de la herida.
Los estudios que comparan la cura húmeda con la tradicional muestran que, aunque los apósitos modernos tienen un coste inicial más elevado, a medio plazo suponen un ahorro para el sistema sanitario.
Por ejemplo, las úlceras venosas tratadas con cura húmeda cicatrizan en promedio cinco meses antes que aquellas tratadas con cura seca, en las que el proceso puede alargarse hasta 48-50 meses. Esta diferencia es frustrante tanto para el paciente como para el personal de enfermería, ya que la cura húmeda consigue los beneficios mencionados con anterioridad de forma más rápida y eficaz.
Curas Húmedas
La Cura en Ambiente Húmedo en las heridas crónicas ha demostrado que produce: (2)
- Una cicatrización acelerada favorecida por el grado de humedad que se mantiene de forma exacta.
- Genera una protección aumentada frente a la colonización por agentes patógenos.
- Técnica muy versátil frente a la gasa tradicional ya que existen una amplia gama de apósitos que se adaptan a la situación patológica (mayor o menor absorción, impermeabilidad, mayor o menor poder antibacteriano…).
- La cura se convierte en un procedimiento menos doloroso y traumático para el paciente puesto que los apósitos no se quedan adheridos a la piel o al lecho de la herida.
Además, si nos centramos en los estudios que revelan la eficacia de la cura húmeda frente a la tradicional, los resultados establecen que, aunque los apósitos de las nuevas formas de tratamiento son más costosos que el material tradicional; este tipo de cura supone un menor gastos la sanidad.
Muestra de ello es que las ulceras venosas se curan en un promedio de unos cinco meses menos que aquellas que se tratan con curas secas; donde el tratamiento puede alargarse hasta unos cuarenta y ocho o cincuenta meses; algo que se vuelve desesperante para el profesional de Enfermería y para el paciente ya que la cura en ambiente húmedo genera los beneficios mencionados con anterioridad.
Curas Secas
La cura seca se usa poco ya que retrasa la cicatrización. Consiste en mantener la herida limpia y seca para prevenir infecciones, siendo la responsable de:
- Disminuir la temperatura en el lecho de la úlcera, provocando que las células sanas se sequen y mueran.
- Eliminar la humedad, originando que las células epidérmicas emigren hacia el interior, retrasando el proceso de cicatrización.
- Originar una costra, que se fija en planos inferiores mediante fibras de colágeno, impidiendo la aparición del nuevo tejido.
- Exponer la herida a contaminantes externos.
Sin embargo, si nos fijamos en el análisis de los costos en función del tiempo de evolución de las heridas crónicas, es cierto que, inicialmente las curas avanzadas son mucho más costosas que las tradicionales, pues se precisa de un material específico y de profesional cualificado para realizar dicho procedimiento.
En las heridas en las que se emplea cura seca , se debe prestar extrema atención al momento en que se retira el apósito, pues al estar adherido al lecho de la herida causa extremo dolor para los enfermos y es uno de los motivos por los que rechazan las curas.
Es preciso conocer, por todos los profesionales de la salud, que este tipo de cura sólo debe ser empleado en las heridas quirúrgicas o en aquellas heridas que presenten zonas sin vascularización, con signos evidentes de necrosis. Con el objetivo de frenar el avance de la lesión, en el caso de que no haya tratamiento quirúrgico, como por ejemplo, en el caso de las lesiones isquémicas.
La cura seca usa materiales de baja absorción y alta capacidad de desecación, representados por gasa y algodón, en forma de compresas, apósitos o torundas. Estos materiales son pasivos, en el sentido de que no intervienen en el proceso de cicatrización y, peor aún, lo lentifican y complican. Varios estudios aleatorios han demostrado que estos materiales disminuyen la cicatrización, aumentan los costos, aumentan la incidencia de infección y generan más dolor.(3)
las curas se caracterizan por ser de frecuencia diaria, dolorosas, ya que en cada evento de curación se remueve tejido sano de manera cruenta con sangrado y dolor, son más costosas, porque implican gastos para el proveedor de salud y para el paciente en cada consulta para la curación, y alargan el periodo de cicatrización, haciéndolo más susceptible a complicaciones locales o sistémicas (3)
Lamentablemente, se caracterizan por un alto nivel de empirismo por parte de las personas que lo realizan, sumado a conceptos de cultura popular y folclor que van en detrimento de la atención profesional, como el uso de plantas, azúcares tipo panela, soluciones antisépticas como el peróxido de hidrógeno, soluciones yodadas o con cloro, que se ha demostrado que lentifican y complican el proceso de cicatrización, tanto en heridas agudas como crónicas. (3)
Para la cura se utilizan productos pasivos aquéllos que no interactúan con la herida, tienen alta capacidad de desecación y poca absorción, y además, favorecen la infección. Son los usados en la curación convencional. El más representativo es la gasa tejida o prensada, material de origen natural que destruye el tejido de granulación en diferencia con los Productos activos que son los utilizados en la curación avanzada y son activos porque interactúan con la herida favoreciendo su proceso de cicatrización.(3)
Sin embargo, a pesar de haber sido superada por la cura en ambiente húmedo, no se puede ignorar pues sigue estando justificada en determinados casos: (4)
- Curación de heridas cerradas por primera intención (suturas, grapas, etc.) – Como medida de protección frente a infecciones secundarias. – Como acolchado de protección frente a irritaciones mecánicas.
- Además de en heridas agudas, la CT se viene utilizando en lesiones isquémicas no revascularizadas, con el objetivo de evitar infecciones, no la curación. Así mismo, para delimitar necrosis cara a una posterior resección (amputación mayor o menor).
Finalmente, El 90% de los estudios han demostrado que, la curación húmeda en pacientes con heridas crónicas como las úlceras venosas, presentan una cicatrización acelerada acompañada de una disminución evidente de las complicaciones de la patología y una mejora en la calidad de vida del enfermo.(5)

La mayoría de las curas secas se realizan con la povidona yodada, pero, si esta está indicada para su uso en piel sana e intacta, ¿es correcto su uso en heridas crónicas?.
La povidona yodada tiene un tiempo de actividad de 3 min y un efecto residual de 3h. Se ha demostrado que retrasa el crecimiento del tejido de granulación, y puede producir efectos sistémicos adversos, tales como acidosis metabólica; hipernatremia, trastornos de la función renal, hepática y tiroidea.
Además, es incompatible con las enzimas proteolíticas como la colagenasa, por ello si se utiliza previo al desbridamiento la inactiva, al igual que los productos con plata.(4)
En la siguiente tabla podemos ver las diferencias entre curas húmedas y secas.

4 motivos por el que realizar una cura en ambiente húmedo
Guía del Ministerio de Sanidad, Manual de consenso de profesionales y Sumario de Evidencias (SE) de Uptodate, definen a la cura húmeda frente a la cura seca como nivel de evidencia alto.
Según las guías de práctica clínica consultadas podemos indicar 5 motivos por el que realizar CAH:
1 – Previene la formación de costras y cicatrices antiestéticas
En un entorno húmedo, se previene la formación de costras. Si las heridas se curan sin costras y el proceso de curación y la formación de nuevo tejido permanece intacto, la probabilidad de cicatrización disminuye obteniendo mejores resultados estéticos. Las heridas que se dejan secar al aire siempre crearan costras, lo que dificultará que la herida cierre por sí misma. Bajo estas condiciones secas, el nuevo tejido tendrá dificultades para formarse. Lo que muchos no saben: una costra no es un signo de curación saludable, en realidad impide que la piel se cure y se recupere de nuevo.
2 – Porque acelera hasta 2 veces la curación
Explicado anteriormente – Pulsa aquí
3 – Mantiene la flexibilidad en la herida
Las cicatrices tienen un aspecto diferente al de la piel normal. Esto se debe a que la piel está formada por dos proteínas: la elastina, que le proporciona flexibilidad, y el colágeno, que le confiere resistencia. El cuerpo no puede crear elastina nueva; por lo tanto, las cicatrices están hechas completamente de colágeno. Por eso son más duras y menos flexibles que la piel circundante.
4 – Por su alta tolerancia cutánea, evitando y reduciendo el estrés oxidativo
Ya que rellenan el estrato corneo, reforzando la función barrera de la piel en las pieles sensibles. ¿qué es el estrés oxidativo? El exceso de ROS, del que mencionamos anteriormente en los factores que reducen la cicatrización, produce estrés oxidativo y retraso en la cicatrización. Por tanto, la reducción del estrés oxidativo permite reactivar el proceso de cicatrización que se ha estancado en la fase inflamatoria. (1,5)
Por tanto; el estrés oxidativo es el resultante de un exceso de radicales libres de oxígeno en el cuerpo humano. Los radicales libres son especies con uno o más electrones desapareados altamente inestables que hacen que reaccione con otras moléculas generando nuevos radicales libres. Cuando los antioxidantes no son suficientes para contrarrestar los radicales libres y aumenta su número en la célula incrementa la actividad oxidativa en el interior de la célula, se produce un cambio estructural y funcional de la misma lo cual acelera su envejecimiento y favorece la apoptosis o muerte celular.
También queremos invitaros a leer este artículo de Enfermería Ciudad Real, donde se pueden encontrar extractos de nuestros artículos sobre Cura Húmeda y Cura Seca.
Artículo Cura Húmeda y Cura Seca
Para saber más sobre las diferencias entre curas húmedas y secas puedes consultar aquí
Bibliografía:
- CuiDsalud. Controlar el estrés oxidativo como estrategia para favorecer la cicatrización de heridas crónicas [Internet]. CuiDsalud. 2020 [citado 3 de julio de 2021]. Disponible en: https://cuidsalud.com/estres-oxidativo-heridas/
- Preevid SM de S. Banco de preguntas Preeevid. Ventajas que justifican el uso de la cura húmeda frente a la seca en las úlceras por presión (upp) [Internet]. Preevid. Servicio Murciano de Salud. Region de Murcia; 2015. Disponible en: http://www.murciasalud.es/preevid.php?op=mostrar_pregunta&id=20864
- Ortiz-Vargas I, García-Campos ML, Beltrán-Campos V, Gallardo-López F, Sánchez-Espinosa A, Ruiz Montalvo ME. Cura húmeda de úlceras por presión. Atención en el ámbito domiciliar. Enfermería Universitaria. 1 de octubre de 2017;14(4):243-50.
- https://sanidad.castillalamancha.es/sites/sescam.castillalamancha.es/files/documentos/farmacia/bft_1_2018.pdf.
- Qué es el estrés oxidativo. Causas, síntomas y tratamiento [Internet]. Global Remediation. Laboratorio de la Naturaleza. 2017 [citado 3 de julio de 2021]. Disponible en: http://www.globalremediation.es/que-es-el-estres-oxidativo-causas-sintomas-y-tratamiento/E

La radiodermitis, un efecto secundario de la radioterapia: qué es y cómo paliarlo

¿Por qué hay quien no tolera las medias de compresión?
Insuficiencia Venosa Crónica
Tendencia
-

 Divulgaciónhace 6 años
Divulgaciónhace 6 añosLa radiodermitis, un efecto secundario de la radioterapia: qué es y cómo paliarlo
-
 Divulgaciónhace 4 años
Divulgaciónhace 4 años¿Por qué hay quien no tolera las medias de compresión?
-
 Divulgaciónhace 3 años
Divulgaciónhace 3 añosInsuficiencia Venosa Crónica
-

 Divulgaciónhace 7 años
Divulgaciónhace 7 añosPresentación de un caso de quemadura por cáusticos en Paciente Diabético
-

 Divulgaciónhace 5 años
Divulgaciónhace 5 añosLesiones por humedad
-

 Productoshace 5 años
Productoshace 5 añosApositos DACC Cutimed Sorbact
-

 Divulgaciónhace 7 años
Divulgaciónhace 7 añosDesbridamiento
-

 Divulgaciónhace 7 años
Divulgaciónhace 7 añosCaso clínico de pie diabético en C.M.U.C.














You must be logged in to post a comment Login